W jednym miejscu zebrałam dla Ciebie najistotniejsze informacje o chemii chromu, które są niezbędne do zdania matury. Podstawowe właściwości, reakcje, tlenki, chromiany i dichromiany, przejścia. Zapraszam do lektury!
Chrom:
liczba atomowa – 24
nr grupy – 6
nr okresu – 4
blok – d
konfiguracja powłokowa – K2 L8 M13 N1
konfiguracja podpowłokowa – 1s2 2s2 2p6 3s2 3p6 4s1 3d5
wartościowość w związkach – II, III, IV*, V*, VI
*- chrom na IV i V stopniu utlenienia jest trwały tylko w związkach stałych, natomiast w roztworach wodnych bardzo łatwo ulega dysproporcjonowaniu do związków chromu III i VI.
Podstawowe właściwości chromu:
- metal o pięknym srebrzystym połysku
- odporny na korozje (wykonuje się z niego powierzchnie ochronne dla stali)
- ulega pasywacji pod wpływem kwasów utleniających – pokrywa się tlenkiem chromu (III)
- Charakter kwasowy związków chromu rośnie wraz ze wzrostem stopnia utlenienia
Chrom metaliczny – reakcje
Chrom nie reaguje z wodą, pomimo ujemnego potencjału elektrochemicznego.
Reaguje z kwasem solnym i rozcieńczonym kwasem siarkowym (VI) tworząc związki na (II) stopniu utlenienia (warunki beztlenowe) lub na (III) stopniu utlenienia (warunki tlenowe).
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + H2 + 2H2O
W temperaturze czerwonego żaru chrom reaguje z parą wodną.
2Cr + 3H2O → Cr2O3 + 3H2
Tlenki chromu
Tlenek chromu(II) CrO:
- substancja o barwie czarnej
- charakter zasadowy
- nietrwały
- reaguje z kwasami, np.:
CrO + 2HCl → CrCl2 + H2O
CrO po ogrzaniu w obecności tlenu przechodzi w tlenek chromu(III):
4CrO + O2 → 2Cr2O3
Tlenek chromu(III) Cr2O3
- szarozielona substancja
- trwały związek
- posiada właściwości amfoteryczne – reaguje z mocnymi kwasami i zasadami
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4]
Tlenek ten powstaje podczas termicznego rozkładu wodorotlenku chromu(III):
2Cr(OH)3 → Cr2O3 + 3H2O
Tlenek chromu(IV) CrO2
- czarne ciało stałe
- ma bardzo dobre właściwości ferromagnetyczne
- nietrwały
Tlenek chromu(VI) CrO3
- pomarańczowo-czerwony
- higroskopijny
- posiada charakter kwasowy
- reaguje z wodą, tworząc kwas chromowy(VI):
CrO3 + H2O → H2CrO4
Wodorotlenek chromu(III) Cr(OH)3
- ma charakter amfoteryczny
- szarozielony osad
- wodorotlenek chromu (III) możemy otrzymać np: w reakcji siarczanu (VI) chromu (III) z zasadą sodową:
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3↓ + 3Na2SO4
(zapis jonowy: Cr3++ 3OH– → Cr(OH)3↓)
- roztwarza się pod wpływem nadmiaru zasady do ciemnozielonego związku kompleksowego o liczbie koordynacyjnej 6 – heksahydroksochromian (III) sodu
Cr(OH)3↓ + 3NaOH → Na3[Cr(OH)6]
- oraz pod wpływem mocnych kwasów do soli prostej:
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Chrom na VI stopniu
Związki chromu VI wartościowe mają właściwości silnie utleniające. Zazwyczaj są to sole sodowe i potasowe chromianów i dichromianów.
Chromiany vs Dichromiany
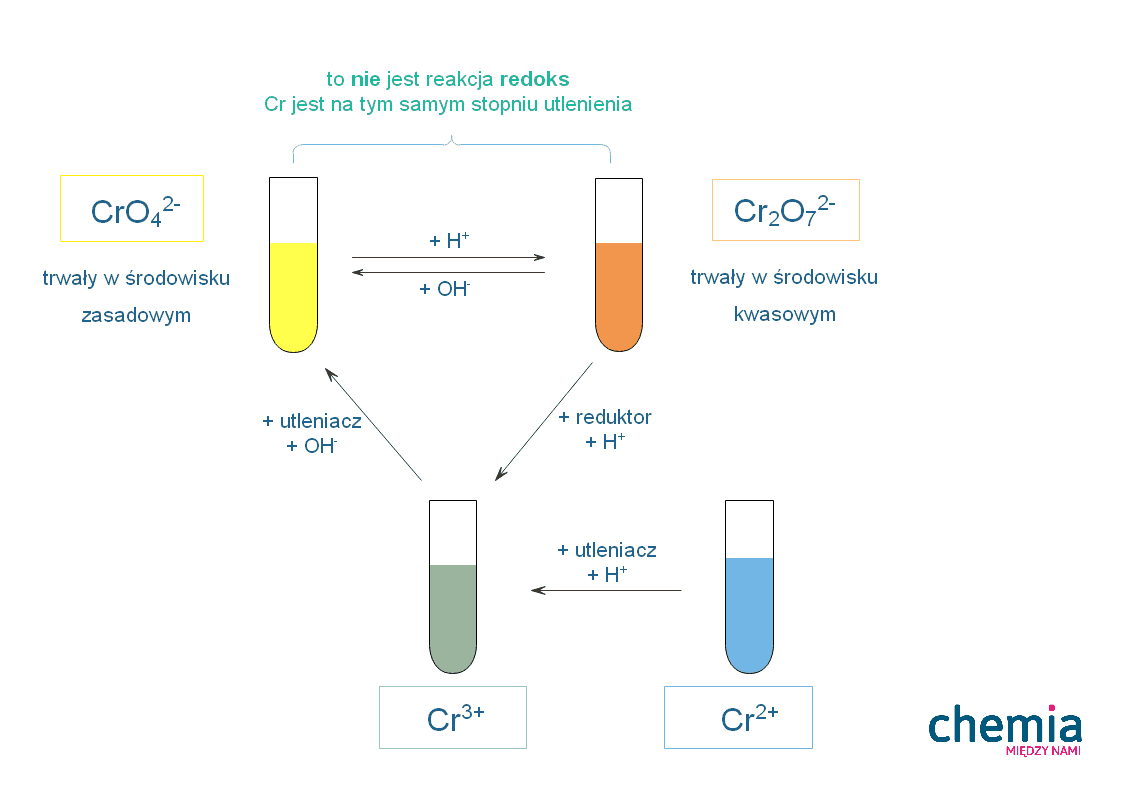
Chromiany i dichromiany zawierają chrom VI – wartościowy. Przejście między chromianami a dichromianami nie jest reakcją redoks (brak zmiany stopnia utlenienia chromu) a reakcją zależną od środowiska.
Chromiany (o kolorze żółtym) są trwałe w środowisku zasadowym, a dichromiany (o kolorze pomarańczowym) w środowisku kwasowym.
Zmieniając środowisko, możemy zamieniać jedne jony w drugie, zgodnie z reakcją:
2CrO42-+ 2H+ ⇆ Cr2O72- + H2O
Przejście chromu III na VI
Sole chromu (III) np.: Na3[Cr(OH)6] w reakcji z nadtlenkiem wodoru w środowisku zasadowym utleniają się do chromianów. Następuje zmiana zabarwienia z zielonej na żółtą.
2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O
reakcja jonowa
2[Cr(OH)6]3- + 3H2O2 → 2CrO42- + 2OH– + 8H2O
Przejście chromu VI na III
Chrom VI-wartościowy wykazuje najsilniejsze właściwości utleniające w środowisku kwasowym, stąd większość reakcji redoks z udziałem chromu (VI) pochodzi właśnie z dichromianów, a nie z chromianów.
Przykładem redukcji chromu (VI) jest reakcja dichromianu (VI) potasu z azotanem (III) potasu w środowisku kwasu siarkowego (VI). Pomarańczowy roztwór przyjmuje barwę zieloną, co świadczy o powstaniu siarczanu (VI) chromu (III).
K2Cr2O7 + 4H2SO4 + 3KNO2 → Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
Ciekawostka:
„Chromianka” to bardzo silnie utleniająca i żrąca mieszanina dichromianu(VI) potasu ze stężonym kwasem siarkowym(VI). Mieszaninę tą stosuje się do oznaczania właściwości redukujących związków, a także do czyszczenia szkła laboratoryjnego silnie zabrudzonego związkami organicznego.